د. محمد محديد*
قال تعالى في محكم تنزيله في الآية 45 من سورة الكهف:
{واضرب لهم مثل الحياة الدنيا كماء أنزلناه من السماء فاختلط به نبات الأرض فأصبح هشيما تذروه الرياح وكان الله على كل شيء مقتدراً} صدق الله العظيم.
للنبات علاقة وطيدة بالماء درسها العلماء بكل تفصيل وتمحص من كل جوانبها العلمية، إذ أصبح يخصص فصل بأكمله تحت إسم العلاقات المائية في النبات Water relations in plant في مقياس تدريس مادة فيزيولوجيا النبات في الجامعات. تطرق القرآن الكريم إلى هذه العلاقة منذ أزيد من 14 قرن!
مع التقدم العلمي، ازداد جيداً إدراك هذه العلاقة ودورها في حياة النبات بعد أن حصل فهم أوسع لقوانين الترموديناميكا[1] وخصائص الماء الفيزيائية والكيميائية وبيولوجيا وفيزيولوجيا الخلية النباتية، وربط كل ذلك بوظائف النبات و تكيفه مع ظروف بيئته.
في البداية أردت أن أعرج قليلاً حول البنية الجزيئية للماء وخواصه الفيزيائية، لأنه لا يمكن فهم هذه العلاقة دون تدقيق في بنية جزيئة الماء وخواصها.
جزيئة الماء:
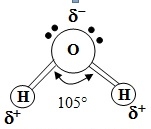
يتكون الماء من ذرة أكسجين واحدة وذرتي هيدروجين، حيث ترتبط كل ذرة هيدروجين مع الأكسجين برابطة تساهمية Covalent bond (رابطة إلكترونية قوية) وتحتاج لتفكيك هذه الرابطة إلى طاقة مقدارها 110 كيلوسعرة/جزيء. لا ترتبط الذرات الثلاثة في جزيء الماء بشكل مستقيم، بل وكما يتبين من الشكل فإن ذرتيّ الهيدروجين يحصران فيما بينهما زاوية مقدارها 105°، وطول الرابطة التساهمية حوالي 0.1 نانومتر (شكل1).
شكل 1: جزئية الماء
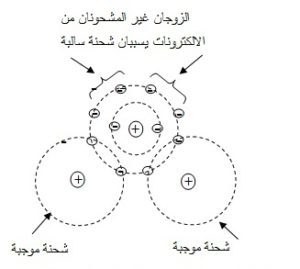
تشارك ذرة الهيدروجين ذرة الأكسجين إلكترونيّها مما ينتج عنه تشبع الغلاف الخارجي لكل من الأكسجين و الهيدروجين وبقاء 4 إلكترونات في المدار الخارجي لذرة الأكسجين غير مساهمة، لذا فهي تكون زوجين حرين كما في الشكل 2. تحمل كل ذرة هيدروجين شحنة جزيئية موجبة نظرا لوجود الإلكترونات في الغلاف الخارجي بقرب ذرة الأكسجين، كما تحمل ذرة الأكسجين شحنة جزيئية سالبة و ذلك لوجود زوجي الإلكترونات الحرة غير المساهمة في غلافها الخارجي.
إن هذا التوزيع يجعل جزيء الماء يتصف بخواص المغناطيس الصغير، فجهة من الجزيء سالبة جزئياً وجهتان موجبتان جزئياً، لذا يوصف جزيء الماء بأنه قطبي Polar ، مع العلم أن الجزيء ككل متعادل كهربائياَ. تنتج الرابطة الهدروجينية Hydrogen bond عند انجذاب ذرة الهدروجين الموجبة لجزيء الماء مع ذرة أكسجين ذات الشحنة السالبة في جزيء آخر من الماء، ولكن هذه الرابطة أضعف من الرابطة التساهمية، وعلى العموم ليس هناك حدوداً معينة لعدد جزيئات الماء التي ترتبط معاً بروابط هيدروجينية.
شكل 2: تكوين الروابط التساهمية و أزواج الإلكترونات الحرة و مكان الروابط الهدروجينية في جزيئ الماء (الأسهم)
خواص الماء:
السيولة، التبخر والحرارة النوعية
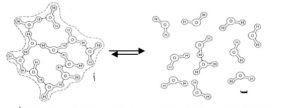
يمتاز الماء بخواص فيزيائية عديدة مثل السيولة، بفضل وجود الروابط الهدروجينية تعمل على تجميع جزيئات الماء مع بعضها البعض (الشكل 3). يكون الماء أيضاً روابط هدروجينية مع غيره من الجزيئات الكبيرة الموجودة في خلايا الكائنات الحية مثل البروتينات و السكريات و الأحماض النووية، حيث تتكون الروابط الهدروجينية نتيجة وجود مجاميع على تلك الجزيئات مثل المجموعة الكيتونية (C=O) و المجموعة الهدروكسيلية (OH-) والمجاميع الأمينية (NH+)، وتحيط بتلك الجزيئات الكبيرة مكونة ما يعرف بالماء المرتبط..
شكل 3: الروابط الهدروجينية بين جزيئات الماء تسبب تجمعات موضعية في شكل شبه بلوري للماء(أ) هذه التجمعات مؤقتة وسرعان ما تتفكك إلى أشكال عشوائية(ب)
يمتاز الماء أيضا بظاهرة التبخر بفضل الانتشار Diffusion. إذ سرعان ما تتفكك جزيئاته المتماسكة عن طريق تكسير الروابط الهدروجينية حتى يتحول إلى الصورة الغازية، وهذا بفضل الطاقة الحرة ΔG° الجزيئية للماء [2]. تعرف حرارة التبخر بعدد السعرات المطلوبة لتحويل 1غ من المادة السائلة إلى الحالة الغازية. يبدأ التبخر إنطلاقاً من درجات الحرارة الدنيا أعلى من صفر (حرارة التجمد) إلى غاية الدرجة 100 والتي يبلغ التبخر أقصاه وهو ما يعرف بحرارة الغليان. ينتج عن التبخر تبريد الأسطح المبلولة عند النتح الذي يحدث في أوراق النبات وخاصة أثناء الحر. فللتبخر دور في الحفاظ على الدرجة المثلى للعمليات الحيوية.
كثيراً ما نسمع بأن الماء ملطف حراري[3]، فهو يمتاز بظاهرة الحرارة النوعية Specific Heat وهي كمية الحرارة اللازمة لرفع حرارة 1غ من الماء درجة حرارية واحدة، وتقدر في الماء بحوالي 1 سعرة حرارية أي يحتاج إلى طاقة حرارية عالية لكسر الروابط الهدروجينية و رفع درجة حرارته، وهي أكبر حرارة نوعية في السوائل ما عدا الأمونيا، و يعود سبب ذلك لترتيب جزيئات الماء في الحالة السائلة، حيث تكون ذرات H و O في مستويات تسمح لها بالتذبذب بحرية كما لو كانت أيونات حرة. عندئذ، بإمكان الذرات امتصاص كميات من الطاقة الحرارية دون حدوث ارتفاع سريع في درجة حرارة السائل. وهي ميزة تلطيف الصدمات الحرارية المؤثرة على المادة الحية.
خصائص التماسك والإلتصاق والشد السطحي Cohesion , Adhesion & Surface tension
تتجاذب جزيئات الماء فيما بينها عن طريق الروابط الهدروجينية، فتصبح متماسكة سائلة في درجات الحرارة العادية. تعرف هذه الظاهرة بالتماسك، حيث تفوق قوى تماسك أي سائل آخر على الأرض ماعدا الزئبق. يرتبط الماء مع المواد الأخرى كحبيبات التربة و السليلوز بالتلاصق، ويلاحظ أن المواد التي تبتل بالماء يدخل في تركيبها الأكسجين الذي يكون معرضاً على سطح المادة، حيث يكون مع الماء روابط هدروجينية.
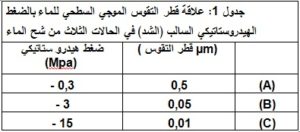
في الحد الفاصل بين الماء و الهواء Air–water interface تكون جزيئات الماء أكثر ترابطاً فيما بينها مقارنة بالحالة الغازية في الجهة الأخرى. ونتيجة لاختلاف قوة الترابط بين الجهتين، يأخذ الحد الفاصل شكلاً يؤدي إلى تقليل مساحة السطح. أي أن باقي جزيئات الماء تؤثر بقوة على الحد الفاصل مما يؤثر على شكل هذا الحد تسمى هذه الحالة بالشد السطحي، وهذه الخاصية مهمة جداً لتوفير القوة اللازمة لسحب الماء إلى قمة الأشجار.
لأكثر توضيح، نلاحظ المثال التالي والذي يبين أنه كلما قلت كمية الماء في جدر الخلايا النباتية في ميزوفيل الورقة بسبب شح الماء وبفضل خاصية ترابط جزيئات الماء فيما بينها، قلت مساحة السطح بين الماء والهواء بخفض قطر تقوسات الحد الفاصل بين الماء والهواء، وبالتالي تزداد قوة الشد السطحي (شكل 4).
شكل 4: في الحالات الثلاث من وفرة الماء ينشأ الشد (الضغط السالب) ويزداد كلما قل الماء، يأخذ الحد الفاصل شكلا يؤدي إلى تقليل مساحة السطح، يسبب الشد السطحي شدا في الطور السائل ومنه يقل قطر التقوس السطحي ومن ثم يزداد الشد. باقي جزيئات الماء تؤثر بقوة على الحد الفاصل مما يؤثر على شكل هذا الحد تسمى هذه الحالة بالشد السطحي.
يمكن توضيح قوة الشد هذه بوضع الماء في محقنة مغلقة بها ماء (شكل 5)، فإذا قمنا بسحب المكبس فستتكون قوة شد أو ضغط سالب، إذ يعود المكبس إلى وضعه. لمقاومة هذا الشد نحتاج إلى قوة لتكسير عمود الماء تعادل قوة الشد بين جزيئات الماء. وقد أظهرت القياسات أن الماء الموجود في أعمدة شعرية صغيرة يمكنها مقاومة شد كبير يصل إلى -30 ميغا باسكال أو -300 بار.
الخصائص الثلاثة: التماسك والإلتصاق و الشد السطحي تؤدي إلى الظاهرة الشعرية، وهو انتقال الماء إلى أعلى في أنبوب زجاجي دقيق أو في أوعية الخشب [1].
شكل 5: تحديد الجهد الضغطي (+) والشد (-) في الحاقنة
الجهد المائي و الترموديناميكا Water potential and thermodynamic
كثيراً ما نشاهد في الطبيعة العديد من العمليات التلقائية أو العشوائية spontaneous process، مثل سيلان النهر، ذوبان الجليد وتبلل الأسطح إلى غير ذلك من هذه الظواهر. لكن في حقيقة الأمر كل هذه العمليات لا تتم ولا تحدث إلا تحت تأثير قوانين الطاقة الحركية أو الترموديناميكا.
يعرف الجهد المائي بأنه الجهد الكيميائي للماء وهو الطاقة الحرة أو طاقة جيبس الحرة (ΔG°)
لكل جزيئّ غرامي (مول) من الماء تحت أية ظروف، سواء كانت تلك المادة نقية أو ذائبة أو كجزء من نظام معقد. فالجهد المائي هو تعبير لكل العمليات الترموديناميكية التي يقوم بها الماء من حركة أو سلوك طاقوي حراري أو تفاعل كيميائي. إذ ينتقل الماء في الخلايا أو الأوساط المفصولة بأغشية نصف نفوذةsemi-permeable من أعلى جهد مائي إلى أقل جهد مائي بواسطة الحلول Osmosis، وينتشر من الأوساط الرطبة إلى الأقل رطوبة بظاهرة الانتشار [5] Diffusion.
يتكون الجهد المائي من كل من الجهدين الأسموزي و الضغطي: Ψ=Ψπ+Ψp. ذوبان أي مادة في الماء قد تخفض من جهد الأول (الأسموزي) نتيجة الإرتباط به، فتصبح جزيئات الماء مقيدة أي أقل جهدا وطاقة و أقل حركة و تبخرا [4]. كما في حالة المحاليل الحقيقية Right Solutions الناتجة عن ذوبان المواد العضوية والمعدنية في الخلايا و النسغ. أما الثاني (الجهد الضغطي) هو ضغط هيدروستاتيكي، فلا يمكن بتاتاً تقليص الحيز أو الحجم الذي يشغله مثلا 1 لتر من الماء، وإلا سييبدي قوة خارجية خارقة. عند الضغط على المكبس فإن الماء سيشكل ضغطاً هيدروستاتيكياً يعيد المكبس إلى سابق وضعه(عد إلى شكل الحاقنة). دخول الماء إلى الخلية عبر قنوات الأكوابورين Aquaporins و إمتلائها بالماء يجعلها أكثر إنتباجاً Turgid، وهي قوة فيزيائية لها فائدة في تمدد جدار الخلية النباتية وبالتالي نمو وكبر الخلية.
لقد عرف الجهد المائي بادئ ذي بدئ تحت إسم الضغط المائي من طرف العالم هنري ديتروشي 1776 ـ 1847م. لأنه أمكن إدراكه عن طريق ملاحظة قيمته في مقياس الضغط Manometer. حيث تضمنت التجربة انتقال الماء بالحلول Osmosis من إيناء الماء المقطر عبر غشاء نصف نفوذ إلى الناقوس الزجاجي المحتوي على كبريتات النحاس والموصول بأنبوبة زجاجية بها ساعة مانومتر تقيس الضغط.
ومع تطور الترموديناميكا تغير تعبير الضغط المائي إلى جهد مائي وبإشارة سالبة، بعد الأخذ بعين الاعتبار قانون الغازات المثالية للعالم راؤول Raoult سنة 1880م و الذي كيفه العالم فانت هوف (1852 ـ 1911) في حالة الجهد الأسموزي آخذا بعين الاعتبار عدد الجزيئات المتأينة ونسب إذابة الجزيئات الخاصة بتركيز المادة بالإضافة إلى درجة الحرارة وثابت الغازات: (Ψ = -CRTi).
إذن الضغط = الجهد لإشارة سالبة [6].
علاقة الماء بالنبات
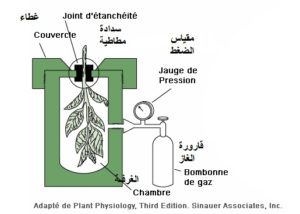
يقاس الجهد المائي بعدة طرق تقليدية لا تفي بالغرض الدقيق في معرفة مقداره بدقة، إلى أن جاءت سنة 1965 إذ اخترع العالم شولندر Scholander غرفة قياس الجهد المائي لغصن نبات تحت تأثير قوة ضغط بضخ الهواء داخل الغرفة الموصولة بالغصن. وتمحورت فكرة العالم في محاولة منه بالإخلال بالروابط الكيميائية بين الماء المرتبط جزيئياً مع مكونات الخلايا النباتية، وأمكنه ذلك بتسليط قوة هائلة من الهواء المضغوط. ونتج عن هذا الإخلال خروج قطرات من الماء عبر أوعية الخشب أو في مجرى النسغ الناقص. وبقراءة الضغط في مقياس المانومتر، أمكنه معرفة قيمة الجهد المائي المرتبط أو المتعلق بمكونات النبات.
تكون مقادير الجهد المائي في النباتات العشبية في حدود –6 إلى –10 بار، لتنخفض أكثر أثناء ظروف الجفاف أو الملوحة. كما أن مقدار الجهد المائي في النباتات الجفافية الصحراوية Xerophytes والملحية Halophytes تصل قيماً أكثر انخفاضاً إلى –200 بار! إذن هي قيم كبيرة جداً، ويتطابق هذا الكبر مع تعلق الماء بالنبات! في كثير من الأحيان عند تقليب التربة الجافة الصلبة والقاسية قد نجد في حضنها جذوراً رطبة ذات محتوى نسبي من الماء! فالماء خلق ليكون أكثر تعلقا بالنبات منه بالتربة!
شكل 6: غرفـة الضغط (قنبلة شولندر) التي تستخدم في قياس الجهد المائي للنسيج النباتي
مصدر قوة الشد النتحي
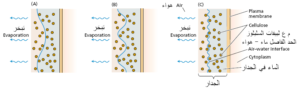
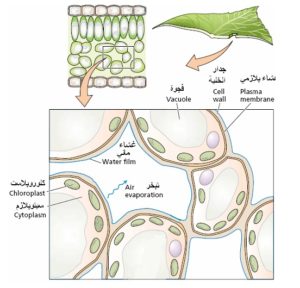
تعتبر آلية الشد النتحي أهم آلية لنقل الماء عمودياً إلى أعلى النبات. عند فقد الماء من جدران خلايا نسيج الميزوفيل في الورقة النباتية إلى الهواء فإن الماء المتبقي يتم سحبه إلى داخل فراغات الجدار( بين اللييفات أو الخلايا) بفضل خاصية الماء التماسكية. ضف إلى ذلك ارتباط أو التصاق جزيئات الماء بألياف السليلوز (شكل 7). في الحد الفاصل بين الماء و الهواء (جدران خلايا نسيج الميزوفيل) تكون جزيئات الماء أكثر ترابطاً مع باقي جزيئات الماء مقارنة بالحالة الغازية في الهواء، يأخذ الحد الفاصل شكلاً يؤدي إلى تقليل مساحة سطح الماء، وهذه الخاصية مهمة جداً لتوفير القوة اللازمة لسحب الماء إلى قمة الأشجار(عُد إلى الشكل 4 و الجدول 1).
شكل 7: ينشأ الشد أو الضغط السالب في الأوراق كتبخر الماء من سطح غشاء الماء على جدار خلايا ميزوفيل الورقة. يتم سحب الماء من ثنايا الجدران، يسبب الشد السطحي شداً في الطور السائل ومنه يقل قطر التقوس السطحي ومن ثم يزداد الشد
يكون مصير الماء بعد سقوط المطر وارتواء الأرض باتجاه النبات وأنسجته، إذ ينتقل الماء من محلول التربة إلى خلايا الجذر عبر الحلول Osmosis وفق التدرج في الجهد المائي من أعلى جهد مائي إلى أقل جهد مائي. صفة التدرج في الجهد مستمرة حتى أثناء فترات شح الماء في التربة، ما دام النبات قادراً على خفض جهده المائي بآلية التعديل الأسموزي التي اكتشفت من طرف العالم Hsiao سنة 1973. و المقصود بالتعديل الأسموزي قدرة خلايا النبات تراكم الذائبات و ما ينجم عنه من انخفاض في الجهد الأسموزي وبالتالي انخفاض الجهد المائي.
في النبات، تكون جزيئات الماء خاضعة لقوة شد في المجالات الأبوبلاستية Apoplastic spaces وهي المجالات الخارجية للخلية النباتية المكونة من لييفات السيليلوز والنصف سليلوز. بالإضافة إلى حالة الماء ضمن محاليل الخلايا والنسغ(جهده الأسموزي) وأيضاً خواص الماء الفيزيائية المذكورة آنفا كلها تجعل الماء متعلقا بالنبات بدرجة كبيرة.
إن المعنى العلمي الذي وصفه الله عز وجل في كلمة الاختلاط في منظوري الإجتهادي هو تطور هذه العلاقة إلى حالة التداخل أو الترابط في الهيئة الجزيئية. حالة تداخل جزيئي بين الماء ومكونات خلايا النبات.
بمجرد زوال الماء من التربة والنبات بسبب جفاف التربة من جهة، وبسبب نضج وشيخوخة النبات من جهة أخرى، يصفر النبات و يصبح هشيما أي حطاماً مثل فتات التبن و القش، أقل كثافة ووزناً يمكن للرياح نقله ونثره والعبث به. في هذه المرحلة تزول علاقة الماء بالنبات بزوال مسبب هذه العلاقة ألا وهو الماء وتكون نتيجة ذلك الموت والحطام.
في الأخير، لقد لخص القرآن الكريم العلاقات المائية بيم الماء والنبات في كلمة وجيزة وهي اختلط أي الاختلاط، وهو المصطلح المبسط للعلاقة الجزيئية بين الماء والنبات. كان هذا منذ أزيد من 14 قرن في زمن لم يكن لعلم الجزيئات والبيوفيزياء والترموديناميكا وجوداً.
_________________________________________
* قسم العلوم الطبيعية، المدرسة العليا للأساتذة القبــــة الجزائر. البريد الإلكتروني: mahdid_m@yahoo.fr
[1]: تهتم بدراسة خواص انتقال الشكل الحراري للطاقة خصوصاً وتحولاته إلى أوجه أخرى من الطاقة ، مثل تحول الطاقة الحرارية إلى طاقة ميكانيكية مثلما في محرك احتراق داخلي والآلة البخارية ، أو تحول الطاقة الحرارية إلى طاقة كهربائية مثلما في محطات القوي , وتحول الطاقة الحركية إلى طاقة كهربائية كما في توليد الكهرباء من سدود الأنهار. وقد تطورت أساسيات علم الترموديناميكا بدراسة تغيرات الحجم والضغط و حركة الجزيئات المتعلقة بالطاقة وبأنواعها.
[2]: ΔG° =E+P V – T.S
حيث أن : G° = الطاقة الحرة ، E = الطاقة الداخلية ، P.V = جداء الضغط x الحجم ،
T = درجة الحرارة المطلقة، S = الأنتروبي Entropy وهي الطاقة المسؤولة عن الحركة العشوائية لأي مادة في محيطها .
لا يمكن من العلاقة السابقة معرفة E و S بدقة أو قياسها، لذلك يصعب حساب G، لكن يمكن معرفة الفرق أو التغير في G بين حالتين كما يلي : ΔG = G2 – G1 ، وتحسب ΔG من المعادلة السابقة (ΔG° = – R T ln C D / A B ) تكون ΔG سالبة في التفاعلات الذاتية التلقائية تحرير طاقة.
تكون ΔG موجبة في التفاعلات غير الذاتية كسب طاقة.
العمليات التلقائية تحتاج في البداية إلى مستوى ابتدائي من الطاقة مرتفع عنه نسبياً من مراحلها النهائية (ΔG)، أي وفق تدرج في الطاقة. ولا تتم هذه العمليات عكسياً إلا في حالة إمداد النظام بالطاقة.
[3] : لا تتغير درجة حرارة الماء بشكل سريع، مثلاً لو تتغير درجة حرارة الجو بشكل سريع فإن ماء الخزان أو الحوض يلزمه أياما ليقارب درجة حرارة الجو. يتطلب أكثر مدة بالنسبة إذا تعلق الأمر بماء البحر!
[4]: الماء المقطر أسرع تبخراً من المحلول السكري أو الملحي، يتجمد الماء المقطر عند صفر درجة مئوية أما في حالة المحلول السكري درجة تجمده أقل من صفر. الماء المقطر يغلي في درجة حرارة 100°م أما في حالة المحلول السكري درجة غليانه أقل من 100.
[5]: من أمثلة الانتشار العادي للماء(من أعلى تركيز إلى أقل تركيز للماء) تبلل الأغذية الجافة المخزنة بالماء، تشبع جو الحمام ببخار الماء وعند فتح النوافذ تحدث تهوية لغرفة الحمام.
[6]: يكون الجهد المائي دوماً سالباً بسبب وجود الذائبات، وأعلى قيمة للجهد المائي صفر في الماء المقطر.
المراجع References
كريمر – بول ج (1983) ترجمة د. قتيبة محمد حسن ، العلاقات المائية للنباتات، كلية الزراعة، جامعة بغداد.
محمد جمال الدين حسونة (1977) أساسيات فيزيولوجيا النبات، دار المطبوعات الجديدة، الإسكندرية ، مصر.
ايفيت يعقوب (1985) ترجمة د. عاصم محمود حسين، مقدمة فسلجة النبات، جامعة الموصل، العراق.
محمد حمد الوهبي (1984) العلاقات المائية في النبات، عمادة شؤون المكتبات- جامعة الملك سعود، الرياض.
عماد الدين وصفي (1998) عماد فيزيولوجيا النبات، المكتبة الأكاديمية، القاهرة مصر.
Luttge U. ; Kruge M., Bauer G. traduit et adapté par Veronique et Andre Sieffert (1992) BOTANIQUE, TEC & DOC Lavoisier France.
Taiz L. and Zeiger E. Plant Physiology (1991) the Benjamin cummings publishing company inc, California, USA.
Willer C.M. (1983) Stomata Longman Group Limited, London; UK.
Richter Gerhard (1993) métabolisme des végétaux physiologie et biochimie traduction et adaptation française de Gabrielle Reymond, press polytechniques et universitaires Romandes.
René Heller ; Robert Esnault ; Claude Lance (2000) ; Physiologie végétale tome : 1- Nutrition, Edition de l’abrégé.
Salisbury F.B., Ross C.W (1978) Water, solutions and surfaces –Water potential, Osmosis in Plant Physiology. Wadworth Publishing Company Inc. Belmonth California USA